- Home
- Dierziektes
- Bluetongue
Blauwtong (bluetongue)
Bluetongue (blauwtong) is een niet-infectieuze virusziekte. De ziekte wordt veroorzaakt door een Orbivirus, dat hoofdzakelijk de binnenzijde van kleine bloedvaten aantast, waardoor oedeem, bloedingen en ulcera kunnen ontstaan. Dieren kunnen elkaar niet onderling besmetten, het virus wordt overgebracht door stekende insecten van het type Culicoides (“knutten”).
Blauwtong is een meldingsplichtige ziekte volgens uitvoeringsverordening (EU) 2018 /1882 van Animal Health Regulation (AHR) (EU) 2016 /429. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA.
Voor meer informatie over de regelgevingen melden kijk op: nvwa.nl/onderwerpen/dierziekten/melden-dierziekte
Voor actuele informatie verwijzen we naar ons Dossier blauwtong. Op de dossierpagina vind je ook de veelgestelde vragen, het behandelplan van GD en altijd de meest actuele nieuwsberichten.
Veterinair kennisdossier Blauwtong
- Verschijnselen
- Diagnose
- Prevalentie
- Aanpak besmette bedrijven
- Preventie
- Regelgeving
- Websites en literatuur
- Bijlage foto's rund
- Bijlage foto's schaap
Het agens
De veroorzaker van blauwtong is een Orbivirus dat door culicoidesvliegjes wordt verspreid (incidenteel door andere stekende insecten en door het overspuiten van bloed via naalden). Het Orbivirus is een RNA-virus waarvan meer 35 serotypen bekend zijn. De verschillende serotypen veroorzaken allemaal ongeveer hetzelfde ziektebeeld, maar geven onderling geen aanleiding tot kruisimmuniteit. Alleen serotypen 1-24 zijn meldingsplichtig.
Gevoelige diersoorten
Blauwtongvirus veroorzaakt vooral klinische verschijnselen bij schapen, echter alle herkauwers en camelidae zijn gevoelig en spelen een rol in de epidemiologie. Klinische verschijnselen zijn beschreven bij schapen, runderen, geiten, herten, reeën, rendieren, cameliden, wisenten, Amerikaanse bisons en carnivoren. Ervaringen in Europese dierentuinen lijken erop te wijzen dat herkauwers van Afrikaanse origine geen klinische verschijnselen vertonen (ook al zijn ze in Europa geboren (persoonlijke communicatie 2009 Christine Kaandorp-Huber als vertegenwoordiger internationale groep dierentuindierenartsen)).
Een verwant virus veroorzaakt epizootic hemoraghic disease (EHD) bij herten. Dit virus kan ook runderen besmetten en klinische verschijnselen veroorzaken sterk lijkend op blauwtong (o.a. uitbraken in USA, Frankrijk, Spanje en Israël beschreven). Een eerste uitbraak van EHD binnen Europa is begin november 2022 vastgesteld bij een aantal runderen op verschillende bedrijven op het eiland Sardinië (Italië) en later op Sicilië en Spanje. Zowel in Italië als in Spanje is het serotype EHDV-8, dat ook voorkomt in Tunesië, aangetoond bij rundvee.
Volksgezondheid
De mens is niet gevoelig voor het blauwtongvirus.
Desinfectie
Bij blauwtong uitbraken vindt geen ruiming van herkauwers plaats; er is dus geen desinfectie van bedrijfsgebouwen noodzakelijk. Het RNA-virus is gevoelig voor zuren, natrium- en calciumhypochloride (2 – 3%), natriumhydroxide (2%), glutaaraldehyde (2%) en hitte (3 uur bij 50 graden, 15 minuten bij 60 graden of 15 minuten bij 121 graden).
Verschijnselen van Blauwtong
Blauwtong veroorzaakt ziekte en sterfte bij alle herkauwers, maar met name schapen zijn vatbaar. Toch kunnen ook runderen ernstige kliniek vertonen (BTV-3 en BTV-8). Het klinisch beeld wordt gekenmerkt door een laesies op de neus en in de bek en kreupelheid door ontsteking van de kroonranden. De waargenomen klinische verschijnselen zijn het gevolg van aantasting van de endotheelcellen in de bloedvaten, waardoor uitgebreide systemische vaatschade optreedt met vochtuittreding, bloedingen en ischemische degeneratie en necrose van de betrokken weefsels [5,6]. Hoewel de schade door de mortaliteit belangrijk is bij schapen, ontstaat de grootste economische schade door exportbelemmeringen, vruchtbaarheidsproblemen en verlies van de wol.
De ziekte treedt vooral op in het weideseizoen als de knutten actief zijn (in Nederland van april tot eerste nachtvorsten; hoogste infectiedruk van augustus-oktober). Geïnfecteerd sperma en verticale transmissie zijn verdere besmettingsroutes. Hoe de ziekte tussen de seizoenen overleeft is onduidelijk (b.v. overlevende volwassen knutten, toch geringe viruscirculatie in de winterperiode tussen herkauwer en knut, de geboorte van PCR-positieve (vireamisch en infectieuze) kalveren/lammeren).
Klinische verschijnselen
Vermoedelijk varieert het klinisch beeld met het serotype en eventueel bijkomende infecties.
Klinisch beeld bij schapen
Na een incubatietijd van 5-20 dagen krijgen de dieren hoge koorts (5-6 dagen). Na 48 uur treedt neusuitvloeiing en speekselen op met rode slijmvliezen. De neusuitvloeiing wordt mucopurulent, vaak met bloed- en voerbijmenging, en stinkt. Het speeksel is schuimig. De lippen, tandranden en tong zijn gezwollen en gaan kapot, wat zorgt voor stank, en de tong kan blauw worden. De necrotische laesies zitten vooral aan de zijkant van de tong. Slikken is moeilijk. De ademhaling is door de zwellingen bemoeilijkt en sterk verhoogd in snelheid. Diarree/dysenterie kan optreden. De dieren worden kreupel door ontsteking van de kroonranden (dik, purperrood) en lederhuid. Ook kan ontschoening optreden. Acute sterfte kan optreden. Dieren die overleven hebben soms maanden nodig om te herstellen. Daarnaast kunnen de dieren in het chronische stadium sterk vermageren en hun wol (compleet) verliezen. Ook spierverkortingen door verbindweefseling van genecrotiseerd spierweefsel kan optreden. Drachtige ooien kunnen aborteren, ook kunnen lammeren worden geboren met hersenafwijkingen (hydranencephalie, vooral na infectie met door celkweek geadapteerde virussen).
In enzoötische gebieden kunnen 2 beelden optreden. Soms kenmerkt het beeld zich door veel aborterende dieren. Soms treedt onder de lammeren waar de passieve immuniteit afneemt vermagering, zwakte en langzaam herstel op.
Serotype 3 bij schapen
Tijdens de BTV-3-uitbraak in 2023 vallen zieke schapen op door apathie, afzonderen, kreupelheid en /of overmatig speekselen. Bij inspectie van de kop wordt oedeem waargenomen, soms beperkt tot de lippen en zwelling, roodheid, erosie en/of ulceratie van het mond-, oog- en neusslijmvlies. Wanneer schapen de acute fase overleven wordt (peri)artritis en ontschoening waargenomen. Ook vertoont een deel van de schapen verschijnselen die passen bij spiernecrose, zoals stramheid.
Pathologisch onderzoek op BTV-3-geïnfecteerde schapen toont naast bovengenoemde macroscopische verschijnselen ernstig longoedeem aan, al dan niet met hydrothorax en hydropericard. Meerdere schapen vertoonden daarbij ook nog ernstige ulceraties en bloedingen in de penspijlers en/of kleinere bloedingen in de hartspier. Histologisch onderzoek bevestigt de ernst van de orgaanschade. In de oedemateuze longen is sprake van vasculitis en microangiopathie met oedeem, microbloedingen en schade aan de alveolaire septa, wat de zuurstofuitwisseling ernstig beperkt. Bij meerdere dieren is uitgebreide acute tubulaire degeneratie, microangiopathie en vasculitis in de nieren vastgesteld. Ook de kleine bloedvaten in de dermale lamina van de klauw zijn soms aangetast, met verschijnselen van laminitis, loslating van klauwhoorn en secundaire purulente ontsteking in de klauwen.
Klinisch verschijnselen bij runderen
De ziekte verloopt bij koeien vaak subklinisch, hoewel een aantal dieren de ernstige symptomen van het schaap kunnen vertonen. Koorts (>40), stijfheid en bevangenheid in vier benen, speekselen, lip-oedeem, verminderde eetlust, ooguitvloeiing en stinkende neusuitvloeiing worden gezien. Sommige dieren hebben ulcera op de tong, tandranden en neusspiegel. Kroonrandontsteking en ontschoening worden soms gezien. Abortus kan optreden. Als de moeder de infectie vroeg in de dracht doormaakt, kunnen kalveren geboren worden met aangeboren afwijkingen (hydrancephalie/hydrocephalie/blueeyes). Bij infectie laat in de dracht (met een aan cellijnen geadapteerd virus) kunnen tot 20% viraemische kalveren worden geboren (viraemie verdwijnt na 1-3 maanden).
Serotype 3 bij runderen
De klinische symptomen die bij runderen zijn waargenomen bij de BTV-3 uitbraak in 2023 zijn: koorts, (forse)productiedaling, laesies van de neusspiegel, in de mondholte en op de uierhuid, neusuitvloeiing, conjunctivitis en speekselvloed. Daarnaast is kreupel- en stramheid gemeld, waarbij rode en gezwollen kroonranden en verdikkingen van de poten zijn waargenomen. Ook regurgitatie en ontschoening behoren tot de gemelde verschijnselen. Het verloop, de duur van de ziekte, het aantal zieke runderen per bedrijf en de ernst van de verschijnselen bij runderen wisselt sterk. Met name koeien rondom het afkalven kunnen ernstig ziek worden. Als gevolg van ernstige verschijnselen, zoals bijvoorbeeld bij ernstige kreupelheid of ernstig longoedeem, kunnen dieren sterven of in geval van uitzichtloos lijden worden geëuthanaseerd.
Bij pathologisch onderzoek op runderen met BTV-3 werden vooral erosies en ulceraties gezien op de mucocutane overgangen van de liprand en neusspiegel; ulceraties en puntbloedingen in de mondholte en pharynx; en puntbloedingen op het hart, de arteria pulmonalis en de aorta. Bij twee verworpen en/of doodgeboren kalveren is BTV aangetoond in de milt, bij deze kalveren zijn geen verdere afwijkingen aangetoond. Bij histopathologisch onderzoek vertoonden de aangetaste slijmvliezen ulceratie, subepitheliale microbloedingen, oedeem, vasculitis, microangiopathie en microvasculaire thrombose. Incidenteel werd acute spierdegeneratie aangetoond in de tong, de slokdarm, de penswand, skeletspieren en de tunica media van de aorta. De spierdegeneratie die bij sommige dieren in de slokdarm is aangetoond, is mogelijk onderliggend aan de verschijnselen van regurgitatie die vanuit het veld werden gemeld. Waargenomen klinische verschijnselen van BTV-3 bij andere diersoorten in 2023.
BTV-3 is ook aangetoond bij (melk)geiten. In de regel lijken de symptomen, waarbij met name koorts, gezwollen lippen, melkproductiedaling, bloedingen op de uierhuid zijn gemeld, bij geiten milder dan bij schapen en runderen, hoewel ook sterfte is gemeld. BTV-3 is ook aangetoond bij alpaca’s en lama’s. Ook bij deze diersoorten is algehele ziekte en (acute) sterfte door BTV-3 aangetoond.
Morbiditeit/mortaliteit
In een gevoelige koppel schapen is de morbiditeit bij introductie van het virus 50-75% (in Nederland: 10% in 2006, 15-80% in 2007) en de mortaliteit 20-50%. In latere jaren is de morbiditeit dan 1-2%, de mortaliteit kan dan nog hoog zijn onder jonge schapen. Bij BTV-3 werd een mortaliteit van 75% waargenomen bij schapen.
Bij het rund is de morbiditeit rond de 80% en de mortaliteit rond de 1%.
Uitscheiding van de kiem
De kiem wordt niet of nauwelijks door het dier uitgescheiden met secreta (wel iets met sperma en embryo’s, maar dit is niet erg belangrijk in de epidemiologie). De overdracht vindt plaats via Culicoides (actieve vermenigvuldiging in de knut) en passief via andere stekende insecten en naalden.
Uit onderzoek met blauwtongvirus serotype 8 bleek dat knutten moeilijk te infecteren waren, maar daarna zoveel virus bevatten, dat de steek van één knut voldoende was om een rund te infecteren. Bij de uitbraak in 2007 in Ierland bleek de infectie zich bij runderen ook te verspreiden door vaarzen die de nageboorte van een besmette vaars opvraten.
Differentiaaldiagnostiek
Differentiaaldiagnose bij schapen
- MKZ
- Ecthyma
- Ulceratieve dermatosis
- Sheeppox
- Haemonchose
- Fotosensibiliteit
Differentiaaldiagnose bij runderen
- EHD
- MKZ
- IBR
- MD/BVD
- BCK
- Fotosensibiliteit
- Runderpest (uitgeroeid wereldwijd)
Diagnose van Blauwtong
Pathologie
Het sectiebeeld is niet typisch. Omdat er geen twijfel mag bestaan over de herkomst en identificatie van het dier moet bij een verdenking materiaal (milt) voor onderzoek naar het Wageningen BioVeterinary Research (WBVR, ex CVI) in Lelystad worden gestuurd.
Isolatie van de kiem
Isolatie van het virus is mogelijk uit EDTA-bloed en uit miltweefsel tot ongeveer 60 dagen na infectie. Met behulp van de PCR test van WBVR-Lelystad kan het virus tot 180-220 dagen na infectie in het bloed worden aangetoond (persoonlijke communicatie Piet van Rijn (WBVR)).
Overige testen
- Serologie in serum. Hiermee zijn afweerstoffen aantoonbaar vanaf 8 dagen na infectie. Na natuurlijke infectie blijven de afweerstoffen waarschijnlijk levenslang aanwezig. Maternale afweerstoffen zijn na 4 maanden verdwenen (pilot-onderzoek van GD).
- PCR in EDTA-bloed. Hiermee is antigeen aantoonbaar vanaf 2 dagen na infectie. De PCR blijft positief tot 180-220 dagen na infectie. Het dier is dan al niet meer infectieus, maar antigeen is nog aantoonbaar (persoonlijke communicatie Piet van Rijn (WBVR)).
Prevalentie van Blauwtong
De ziekte komt voor in de ‘zeewarme’ gebieden: Afrika, Midden-Amerika, zuidelijke staten van Noord-Amerika, Australië, Nieuw-Zeeland, Azië, Midden-Oosten, Middellandse Zeelanden. Sedert het jaar 2000 is de ziekte ook geconstateerd in Bulgarije (serotype 9 en 16), Roemenië (serotype 9 en 16), Griekenland (serotype 4 en 16), Sicilië (serotype 1,2,4,9 en 16), Corsica (serotype 4) en Spanje/Portugal (serotype 1,4,8).
Monitoring
Sinds 2009 monitort GD met financiering van het ministerie van LNV jaarlijks circulatie van BTV-virus in naïeve dieren. Dit heeft geleid tot de BTV-vrij status van Nederland in 2012. In september 2023 is Nederland de BTV vrije status verloren na introductie van BTV-3.
Nederland
BLAUWTONG IN NEDERLAND 2024
Het eerste bevestigde geval van BTV-3 in 2024 werd gemeld in Ommeren op 17 juni 2024. Sinds de eerste bevestigde bedrijven heeft het virus zich vanaf begin juli binnen enkele weken over grote delen van het land verspreid. Op 22 augustus hadden ruim 5200 bedrijven blauwtong gemeld (1460 klinisch en 3775 PCR-positief getest). Uit eerdere prevalentiestudies bleek dat, ondanks dat veel bedrijven in 2023 in aanraking waren gekomen met blauwtong, de prevalentie op schapen- en melkveebedrijven laag was. Om de verspreiding tegen te gaan, heeft Nederland in het voorjaar het noodgebruik van drie geïnactiveerde BTV-3 vaccins goedgekeurd. Hoeveel schapenbedrijven gebruik hebben gemaakt van de vaccins is onbekend. Begin juli werden duidelijk dat, ondanks vaccinatie, op meerdere schapenbedrijven klinische klachten van blauwtong werden gezien. Opvolging van de eerst getroffen bedrijven wees op een gevarieerder klinisch beeld ten opzichte van de uitbraak in 2023. Kreupelheid overheerst het beeld en de sterfte in de eerste weken na infectie lijkt lager te zijn ten opzichte van 2023. waar vorig jaar een aanzienlijk deel van de geïnfecteerde schapen stierf lijken nu meer schapen de infectie te overleven. Momenteel worden de sterftecijfers geanalyseerd om de impact van de huidige uitbraak te monitoren. Vanaf 5 september 2023 is Nederland besmet met blauwtong serotype 3. Nederland verliest daarmee haar vrijstatus. In de uitbraak die volgde raakten ongeveer 5000 locaties in Nederland geïnfecteerd met BTV-3 in 2023.
Op 15 februari 2012 werd Nederland vrij verklaard van blauwtong serotype 8.
Tussen 18-8-2006 en 15-2-2012 was Nederland besmet met blauwtong serotype 8.
Nederland raakte op 18 augustus 2006 besmet met blauwtong serotype 8. Deze uitbraak heeft zich ook voorgedaan in de omringende landen: Duitsland, België, Luxemburg en Frankrijk. In 2007 heeft de uitbraak – met hetzelfde serotype – zich herhaald en verder uitgebreid naar Engeland, Zwitserland, Denemarken en Polen. De problemen waren toen veel uitgebreider en veel ernstiger. Op basis van onderzoek dat GD heeft uitgevoerd, stierven alleen al in de tweede helft van 2007 ruim 27.000 schapen aan blauwtong. Ruim zestig procent van die sterfte vond in dat jaar plaats in het midden van ons land. In 2008 kwamen nog zestig uitbraken voor, vooral in het noorden. Daarna was de ziekte verdwenen. In 2009 hebben zich geen uitbraken in Nederland meer voorgedaan.
Tussen 21-10-2008 en 6-3-2009 was Nederland besmet met blauwtong serotype 6 (vermoedelijk van vaccinatie-origine).
Andere landen
Figuur 1 toont een overzichtskaart van de blauwtongstatus in de EU-lidstaten. In tabel 1 zijn de in Europa voorkomende blauwtonguitbraken weergegeven, zoals gemeld via Promed en Adis. Voor de meest relevante landen is tevens beschikbare directe informatie van het land zelf geconsulteerd.
In België, Duitsland en Engeland zijn in het eerste kwartaal 2024 besmettingen met BTV-3 gemeld. Onduidelijk is of het hier klinisch zieke dieren betreft of dieren die om andere redenen getest worden. In Frankrijk wordt de nieuwe stam van BTV-8 beschouwd als endemisch aanwezig, waardoor aantallen besmettingen niet meer betrouwbaar kunnen worden weergegeven. Bij een verandering van de epidemiologische situatie, geeft Frankrijk aan hier weer over te rapporteren. Ook op Sardinië (Italië) is BTV-8 aanwezig, naast BTV-4. De BTV-8 stam die op Sardinië aanwezig is, vertoont grote gelijkenis met de stam die in Frankrijk aanwezig is, en niet hetzelfde lijkt te zijn als de BTV-8 stam op het Italiaanse vasteland. Ook Sardinië meldt besmettingen in het eerste kwartaal van 2024, maar specifieert het serotype niet.
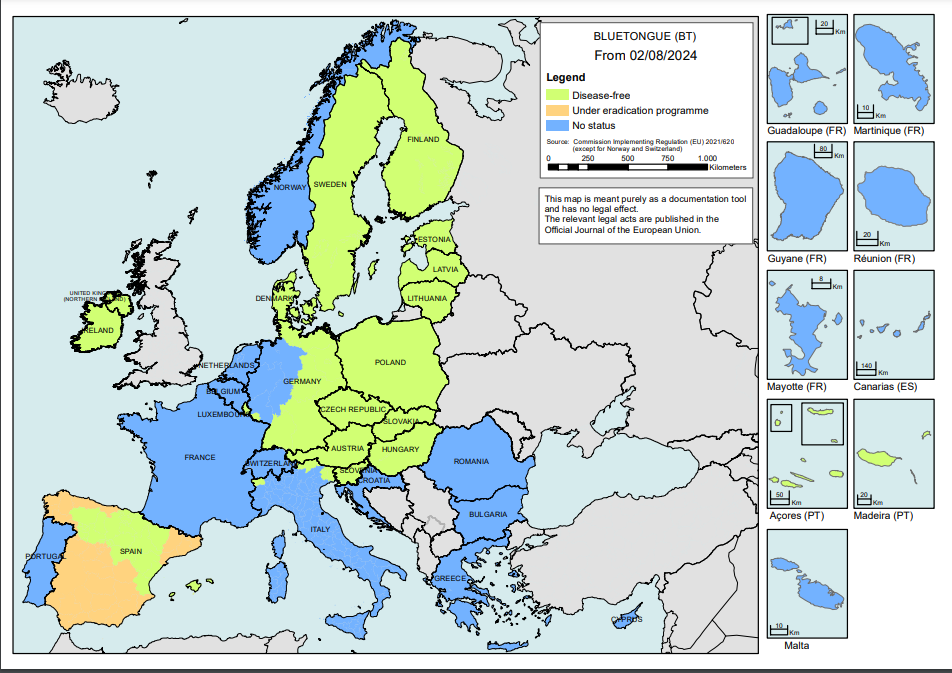
Figuur 1 De toezichtzones per 02-08-2024 (bron: https://food.ec.europa.eu/document/download/0c2e7ca6-96eb-42e9-830e-27f43a3a01ba_en?filename=ad_control-measures_bt_restrictedzones-map.pdf)
Tabel 3.3 Blauwtonginformatie*
|
Land** |
Uitbraken 2022 totaal |
Uitbraken 2023 totaal |
Uitbraken 2024 totaal |
Tweede kwartaal 2024 |
|
België |
0 |
5 |
3 |
Één nieuwe besmetting |
|
Duitsland |
0 |
24 |
85 |
56 nieuwe besmettingen |
|
England |
0 |
34 |
48 |
Geen nieuwe besmettingen |
|
Frankrijk |
0 |
>1.300 |
**** |
**** |
|
Italië |
108*** |
420 |
**** |
**** |
|
Portugal |
8 |
0 |
0 |
0 nieuwe besmettingen |
|
Spanje |
6 |
15 |
4 |
Drie nieuwe besmettingen |
|
Albanië |
7 |
0 |
0 |
0 nieuwe besmettingen |
|
Bulgarije |
1 |
0 |
0 |
0 nieuwe besmettingen |
|
Cyprus |
4 |
0 |
0 |
0 nieuwe besmettingen |
* Bron: websites Animal Disease Information System (ADIS), World Organisation for Animal Health (WAHIS), Promed, https://wahis.woah.orghttps://animal-diseases.efsa.europa.eu/BTV.
** Landen worden in de tabel opgenomen zodra in het lopende jaar of de voorgaande twee jaar uitbraken waren.
*** De gemelde uitbraken in Italië betreffen het eiland Sardinië. Op het vasteland van Italië zijn in 2022 geen uitbraken van blauwtong gemeld.
****Één of meerdere BTV-serotypes worden beschouwd als endemisch aanwezig, waardoor aantallen niet meer door de betreffende landen worden bijgehouden of gemeld.
Gemelde uitbraken in 2021 en 2022
Via Promed zijn in het derde kwartaal van 2022 meldingen van blauwtonguitbraken bij schapen gemeld vanuit verschillende districten in midden Portugal. In Zuid-Portugal is bekend dat zowel BTV1 als BTV4 (donkerblauw gebied, figuur 2) een rol kan spelen. Verder is een uitbraak bij runderen in Spanje gemeld (BTV4) en in Duitsland (BTV8). Beide uitbraken waren in een reeds bekend restrictiegebied. In het vierde kwartaal van 2022 zijn uitbraken gemeld in de regio’s Salamanca en Oropesa in Spanje. De restricties die reeds heersten in de regio Ávila zijn hierdoor uitgebreid naar deze twee regio’s, die voorheen als vrij werden beschouwd (figuur 2). In beide gevallen betreft het uitbraken van het BTV4-serotype bij schapen. Ook op Cyprus zijn eind 2022 drie uitbraken gemeld onder schapen en geiten (BTV4), allen in de regio Famagusta. Sardinië wordt al ruim 20 jaar geraakt door heftige uitbraken van blauwtong bij schapen. In november 2022 staat de teller op 108 uitbraken (tabel 1). Tevens werd vastgesteld dat er naast het endemisch aanwezige BTV1 en BTV4, ook het serotype BTV3 verantwoordelijk was voor uitbraken. Dit serotype wordt op dit moment enkel vastgesteld in (het zuiden van) Sardinië. In tegenstelling tot de andere serotypes is op dit moment geen geïnactiveerd vaccin met BTV3 commercieel beschikbaar.
Gemelde uitbraken 2020
- Frankrijk: augustus, een toenemend aantal dieren besmet met het blauwtongvirus serotype 8 (BTV8) gemeld, voornamelijk in het uiterste Zuidwesten van het land. Dit gaat gepaard met duidelijke en ernstige klinische symptomen zoals abortus bij rundvee tot sterfte bij schapen. De geïnfecteerde dieren vertonen een hoge virale belasting (Bron: FAVV).
- Novel Putative Bluetongue Virus Serotype 29 Isolated from Inapparently Infected Goat in Xinjiang of China
Heng Yang 1 , Wenxi Gu 2 , Zhanhong Li 1 , Ling Zhang 2 , Defang Liao 1 , Jianling Song 1 , Shi Baoxin 2 , Jiapaer Hasimu 3 , Zhuoran Li 1 , Zhenxing Yang 1 , Qi Zhong 2 , Huachun Li 1, Transbound Emerg Dis. 2020 Nov 15
Aanpak besmette bedrijven
Meldingsplichtig
Blauwtong is een meldingsplichtige ziekte volgens uitvoeringsverordening (EU) 2018 /1882 van Animal Health Regulation (AHR) (EU) 2016 /429, categorie C+D+E. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA. De aanpak van besmette bedrijven wordt uitgevoerd volgens de dan geldende draaiboeken.
Vaccinatie
BTV-3
Sinds het voorjaar 2024 zijn er meerdere vaccins onder een noodverordening (artikel 110) toegelaten op de Nederlandse markt om runderen en schapen te beschermen tegen BTV-3. Dit betreft geïnactiveerde vaccins van SYVA, Boehringer Ingelheim en Kernfarm.
In Duitsland is tijdelijk gevaccineerd met een autogeen vaccin, hier werden echter na het gebruik hiervan klinische verschijnselen bij een groot percentage van de gevaccineerde dieren waargenomen. Dit vaccin is uit de handel genomen.
BTV-8
In Noordwest-Europa is vaccinatie tegen serotype 8 sinds 2008 toegestaan met geinactiveerde vaccins. De vaccins van Merial en Intervet-Sheeringplough (nu MSD Animal Health) waren hiervoor voorlopig geregistreerd in Nederland. In Zuid-Europa wordt actief tegen verschillende serotypen gevaccineerd bij schapen (levend geattenueerde en dode vaccins).
Het gebruik van levend geattenueerde vaccins geeft bij drachtige schapen risico op verwerpen en de geboorte van afwijkende lammeren (hydranenchephalie). Gebruik tijdens het vliegseizoen van de culicoides wordt afgeraden. De mogelijkheid bestaat dan namelijk dat door circulatie van vaccin-virus en verschillende serotypen nieuwe serotypen ontstaan.
Toch is sinds 1-8-2012, door een aanpassing van richtlijn 2000/75/EG, vrijwillige vaccinatie tegen serotype 8 weer toegestaan, mits met een geregistreerd en niet-levend BTV-8 vaccin.
Antibiotica
Niet van toepassing. Alleen ondersteunend tegen secundaire infecties. Elke verdenking van blauwtong dient te worden gemeld bij NVWA. NVWA zorgt voor monstername, zodat de infectie kan worden aangetoond of uitgesloten. Als een dier eenmaal is besmet, is behandeling niet mogelijk. Een behandeling van de symptomen, aangevuld met antibiotica tegen secundaire bacteriële infecties, kan het lijden wat verlichten.
Overige maatregelen
Het risico van besmetting met blauwtong hangt nauw samen met de activiteiten en de leefomstandigheden van de belangrijkste virusverspreider, de knut.
Zo neemt het risico van een blauwtong-besmetting toe:
- in de periode van eind mei tot eind oktober, als de volwassen knutten vliegen;
- tussen zonsondergang en zonsopgang (inclusief de schemering);
- in (de buurt van) een vochtige omgeving dat organisch materiaal bevat (plassen, poelen, langzaam stromend water), waar de knutten zich voortplanten.
Preventieve maatregelen tegen blauwtong zijn het opstallen gedurende de schemering en de nacht (bij paarden met staart-en-manen eczeem werkt dit zeer effectief). Uit onderzoek van de GD blijkt dat bedrijven met een beperkt aantal weide-uren en bedrijven met stallen met grote lucht-inlaat-openingen (>30 cm) een lagere prevalentie van blauwtong hebben.
Programma’s buitenland
Geen, buiten vaccinatie.
Preventie van Blauwtong
Opstallen en mechanische overdruk-ventilatie dragen bij het aan het beperken van het risico op contact met knutten. Monitoring in vrije gebieden draagt bij aan een vroege signalering (zodat tijdig gevaccineerd kan worden om spreiding te voorkomen).
Regelgeving
Vanaf 21 april 2021 is de nieuwe Europese diergezondheidsverordening, of Animal health regulation (AHR) van toepassing. Met deze verordening wordt de aanpak van dierziekten binnen de Europese Unie meer met elkaar in overeenstemming gebracht. Voor zover de AHR geen rechtstreekse werking heeft, is deze in Nederland per 21 april 2021 geïmplementeerd in of op basis van de Wet Dieren. Iedere lidstaat is verplicht om een monitoringsysteem uit te rollen voor het opsporen van door de EU aangewezen ziekten en relevante nieuwe ziekten.
Op basis van de AHR worden in Uitvoeringsverordening (EU) 2018/1882 van de commissie van 3 december 2018 dierziekten gecategoriseerd en ingedeeld in A-, B-, C-, D- en E-ziekten.
Blauwtong valt in categorie C+D+E:
- C. Dierziekten die relevant zijn voor sommige lidstaten en waarvoor maatregelen nodig zijn om te voorkomen dat zij zich verspreiden naar andere delen van de Unie die officieel ziektevrij zijn of waarin een uitroeiingsprogramma voor de dierziekte loopt;
- D. Dierziekten waarvoor maatregelen nodig zijn om te voorkomen dat zij zich verspreiden wegens binnenkomst in de Unie of verplaatsingen tussen de lidstaten;
- E. Dierziekten waarvoor bewaking nodig is binnen de Unie zijn.
De bestrijdingsplicht blauwtong vervalt hiermee. Na 21 april 2021 is het een vrijwillig te bestrijden dierziekte, waarvoor dus wel een officiële vrijstatus mogelijk is. NL is sinds 2012 vrij van BTV en zal per 21 april daarom officieel BTV-vrij zijn. Wel blijft de jaarlijkse monitoring verplicht. Principebesluit is om geen verplichte bestrijding te starten bij besmetting. NL verliest in dat geval de vrijstatus.
Bij (verdenking van) een uitbraak van blauwtong dient de betrokken dierenarts of veehouder dit melden melding bij de NVWA https://www.nvwa.nl/onderwerpen/dierziekten/melden-dierziekte#/
Websites en literatuur
Websites
- Member States’ information on the derogations from the BTV requirements for movements within the EU:
https://ec.europa.eu/food/animals/animal-diseases/control-measures/bluetongue - BLUETONGUE: protocol vervoer herkauwers (Versie: 2.0.9 21-01-2022):
- www.oie.int
- http://www.defra.gov.uk/animal-diseases/a-z/bluetongue/
- http://www.cfsph.iastate.edu/DiseaseInfo/disease.php?name=bluetongue&lang=en
Literatuur
- Backx, A., Heutink, C.G., Van Rooij, E.M.A., and Van Rijn, P.A., 2007.
Clinical signs of Bluetongue virus serotype 8 infection in sheep and goats. Vet. Record. 161, 591-593. - Backx, A., Heutink, R., Van Rooij, E.M.A., Van Rijn, P.A., 2009.
Transplacental and oral transmission of wild-type bluetongue virus serotype 8 in cattle after experimental
infection. Vet. Mic.138, 235-243. - Baldet, T., Delécolle, J.C., Cêtre-Sossah, C., Mathieu, B., Meiswinkel, R., Gerbier, G., 2008.
Indoor activity of Culicoides associated with livestock in the bluetongue virus (BTV) affected
region of northern France during autumn 2006. Prev. Vet. Med. 87, 84-97. - Batten, C., Darpel, K., Veronesi, E., Williamson, S., Anderseon, P., Dennison, M., Clifford, S., Smith, C., Phillips, L., Bachanek-Bankowska, K., Sanders, A., Bin-Tarif, A., Wilson, A., Gubbins, S., Mertens, P., Oura, C., Mellor, P., 2009.
Transplacental transmission of bluetongue serotype 8 (BTV-8) in the United Kingdom (2007-2008). In proceedings of Epizone, 3rd edition. 12-15 May 2009 Antalya, Turkey. - Baylis, M., Parkin, H., Kreppel, K., Carpenter, S., Mellor, P.S., McIntyre, K.M., 2009.
Evaluation of housing as a means to protect cattle from Culicoides biting midges, the vectors of bluetongue virus.
In: Proceedings of the 12th International Symposium on Veterinary Epidemiology and Economics (ISVEE), 10-14 August 2009, Durban, South Africa. - Bekker, J.G., De Kock, G.V.D.W., Quinlan, J.B., 1934. The occurrence and identification of bluetongue in cattle- the so-called pseudo-foot and mouth disease in South Africa. Vet. Res. 2, 393-507.
- Bonneau, K.R., Zhang, N., Zhu, J., Zhang, F., Li, Z., Zhang, K., Xiao, L., Xing, W., MacLachlan, N.J., 1999.
Sequence comparison of the L2 and S10 genes of bluetongue virus from the
United States and the People’s Republic of China. Virus Res. 61, 153-160. - Bonneau, K.R., Demaula, C.D., Mullens, B.A., MacLachlan, N.J., 2002.
Duration of viraemia infectious to Culicoides sonoris in bluetongue virus-infected cattle and sheep.
Vet. Mic. 88, 115-125. - Borkent, A., Wirth, W.W., 1997. World species of biting midges (Diptera: Ceratopogonidae).
Bull. Am. Museum of Nat. Hist. 233, 1-257. - Bournez, L., Cavalerie, L., Sailleau, C., Bréard, E., Zanella, G., Servan de Almeida, R., Pedarrieu, A., Garin, E., Tourette, I., Dion, F., Hendrikx, P., and Calavas, D., 2018. Estimation of French cattle herd immunity against bluetongue serotype 8 at the time of its re-emergence in 2015. BMC Veterinary Research 14:65
- Bowne, J.G., Luedke, A.J., Jochim, M.M., 1967. Bluetongue of sheep and cattle: past, present and future.
J. Am. Vet. Med. Ass. 151, 1801-1803. - Braverman, Y., Linley, J.R., Marcus, R., Frish, K., 1985. Seasonal survival and expectation of infective life of Culicoides spp.
(Diptera: Ceratopogonidae) in Israel, with implications for bluetongue virus transmission and a comparison of the parous rate in C. imicola from Israel and Zimbabwe. J. of Med. Entomol. 22, 476-484. - Calistri, P., Giovannini, A., Conte, A., Nannini, D., Santucci, U., Patta, C., Rolesu, S., Caporale, V., 2004. Bluetongue in Italy: Part I. Vet. Ital. 40, 243-251.
- Caracappa, S., Torina, A., Guercio, A., Vitale, F., Calabro, A., Purpari, G., Ferrantelli, V., Vitale, M., Mellor, P.S., 2003. Identification of a novel bluetongue virus vector species of Culicoides in Sicily. Vet. Rec. 153, 71-74.
- Carpenter, S., Szmaragd, C., Barber, J., Labuschagne, K., Gubbins, S., Mellor, P., 2008. An assessment of Culicoides surveillance techniques in northern Europe: have we underestimated a potential bluetongue virus vector. J. Appl. Ecol. 45,1237-1245.
- CEC, 2000. Council Directive 2000/75/EEC of 20 November 2000 laying down specific provisions for the control and eradication of bluetongue. In Official Journal of the European Communities, pp. 74–83.
- CEC, 2005. Commission Decision of 23 May 2005 on protection and surveillance zones in relation to bluetongue and conditions applying to movements from or through these zones.
In Official Journal of the European Communities, pp. 22–31. - Courtejoie, N., Bournez, L., Zanella, G., and Durand, B., 2019. Quantifying bluetongue vertical transmission in French cattle from surveillance
- Data. Vet Res (2019) 50:34Darpel, K.E., P. Monaghan, S.J. Anthony, H. Takamatsu, and P.P. Mertens. 2009.
Bluetongue virus in the mammalian host and the induced immune response.
In: Bluetongue, P. Mellor, M. Baylis, and P. Mertens, Eds, Elsevier, London, pp. 265-284. - Dercksen, D., Lewis, C., 2007. Bluetongue virus serotype 8 in sheep and cattle: a clinical update. In practice 29, 314-318.
- Demaula, C.D., Leutenegger, C.M., Bonneau, K.R., MacLachlan, N.J., 2002.
The role of endothelial cell-derived inflammatory and vasoactive mediators in the pathogenesis of bluetongue. Virol. 296, 330-337. - EFSA, 2007. Scientific report of the scientific panel on animal health and welfare on request from the commission (EFSA-Q-2006-311) and EFSA selfmandate (EFSA-Q-2007-063) on Bluetongue.
The EFSA journal, 479, 1-29 and 480 1-20. - Elbers, A.R.W., Rijn Van, P.A., Rooij Van, E.M.A., 2003. Attempt to a risk analysis regarding the introduction of bluetongue virus and west nile virus in the Netherlands, in Dutch. CIDC-rapport 2003-02,
http://www.cvi.wur.nl/NR/rdonlyres/CC4EC0FD-3F41-4C98-A2A5-E08903091408/11385/RiskAssessmentBT.pdf, accessed on 20-08-2010. - Elbers, A.R.W., Backx, A., Meroc, E., Gerbier, G., Staubach, C., Hendrickx, G., Spek Van der, A., Mintiens, K., 2008a. Field observations during the bluetongue serotype 8 epidemic in 2006. I.
Detection of first outbreaks and clinical signs in sheep and cattle in Belgium, France and the Netherlands. Prev. Vet. Med. 87, 21-30. - Elbers, A.R.W., Backx, A., Meroc, E., Gerbier, G., Staubach, C., Hendrickx, G., Spek Van der, A., Mintiens, K., 2008b. Field observations during the bluetongue serotype 8 epidemic in 2006. II.
Morbidity and mortality rate, case fatality and clinical recovery in sheep and cattle in the Netherlands. Prev. Vet. Med. 87, 31-40. - Elbers, A.R.W., Backx, A., Ekker, H.M., Spek Van der, A., Rijn Van, P.A., 2008c. Performance of clinical signs to detect bluetongue virus serotype 8 outbreaks in cattle and sheep during the 2006-epidemic in The Netherlands. Vet. Mic. 129, 156-162.
- Elbers, A.R.W., Van der Spek, A.N., Van Rijn, P.A., 2009. Epidemiologic characteristics of bluetongue virus serotype 8 laboratory-confirmed outbreaks in the Netherlands in 2007 and a comparison with the situation in 2006. Prev. Vet. Med. 92, 1-8.
- Elbers, A.R.W., de Koeijer, A.A., Scolamacchia, F., Van Rijn, P.A., 2010. Motives of commercial livestock farmers and hobby holders to vaccinate during a voluntary vaccination campaign against Bluetongue virus serotype 8 in 2008-2009 in the Netherlands.
Vacc. 29, 2473-2481. - Elbers, A.R.W., R. Meiswinkel, 2014 .Culicoides (Diptera: Ceratopogonidae) host preferences and biting rates in the Netherlands: Comparing cattle, sheep andthe black-light suction trap. Veterinary Parasitology 205 (2014) 330–337
- Erasmus, B.J., 1975. Bluetongue in sheep and goats. Aust. Vet. J. 51, 65-170.
- European regulation 1266/2007, 2007. on implementing rules for Council Directive 2000/75/EC as regards the control, monitoring, surveillance and restrictions on movements of certain animals of susceptible species in relation to bluetongue.
http://eur-lex.europa.eu/LexUriServ/site/en/oj/2007-/l_283/l_28320071027en00370052.pdf, accessed on 12-06-2010. - Flannery, J., Sanz‐Bernardo, B., Ashby, M., Brown, H., Carpenter, S., Cooke, L., Corla, A., Frost, L., Gubbins, S., Hicks, H., Qureshi, M., Rajko‐Nenow, P., Sanders, C., Tully, M., Bréard, E., Sailleau, C., Zientara, S., Darpel, K. and Batten, C. 2019. Evidence of reduced viremia, pathogenicity and vector competence in a re‐emerging European strain of bluetongue virus serotype 8 in sheep. Transboundary and Emerging Diseases, online 20 January 2019, doi: 10.1111/tbed.13131
- Galleau, S., Hamers, C., Blosse, A., Bolon, A., Blanchet, M., Goutebroze, S. 2009. Can vaccination prevent transplacental transmission of BTV-8. In proceedings of Epizone, 3rd edition. 12-15 May 2009 Antalya, Turkey.
- Gerdes, G.H., 2004. A South African overview of the virus, vectors, surveillance and unique features of bluetongue. Vet. Ital. 40, 39–42.
- Gerry A.C., Mullens B.A., 2000. Seasonal abundance and survivorship of Culicoides sonorensis (Diptera: Ceratopogonidea) at a southern California dairy, with reference to potential Bluetongue virus transmission and persistence.
J. of medical entomol. 37:675-688. - Gerry, A., Mullens, B., MacLachlan, N.J., Mecham, J., 2001. Seasonal transmission of bluetongue virus by Culicoides sonoresis (Diptera: Ceratopogonidae) on a southern California dairy and evaluation of vectorial capacity as a predictor of virus transmission.
J. Med. Entomol. 38, 197-209 - Gerbier, G., Baldet, T., Hendrickx, G., Mintiens, K., Elbers, A., Staubach, C., Modelling local dispersal of bluetongue virus serotype 8 using random walk. Prev. Vet. Med. 87, 119-130.
- Gibbs, E.P., Greiner, E.C., 1994. The epidemiology of bluetongue. Comp. Immunol. Mic. and Infect. Dis. 17, 197-206.
- Giovannini, A., Calistri, P., Nannini, D., Paladini, C., Santucci, U., Patta, C., Caporale, V., 2004. Bluetongue in Italy: Part II. Vet. Ital. 40, 252-259.
- Green, A.L., Dargatz, D.A., Schmidtmann, E.T., Herrero, M.V., Seitzinger, A.H., Ostlund, E.N., Wagner, B.A., Moser, K.M., Wineland, N.E., Walton, T.E. 2005.
Risk factors associated with herd-level bluetongue virus exposure of cattle in Nebraska, North Dakota, and South Dakota. American Journal of Veterinary Research. 66: 853-860. - Gubbins, S., Carpenter, S., Baylis, M., Wood, J.L.N., Mellor, P.S., 2008. Assessing the risk of bluetongue to UK livestock: uncertainty and sensitivity analysis of a temperature-dependent model for the basic reproduction .
J. R. Soc. Interface 5:363-371. - Gubbler, D.J., 1991. Insects in Disease transmission. In: Gubbler, D.J., 1998. Resurgent vector-borne diseases as a global health problem. Em. Infect. Dis. 4, 442-450.
- Hartemink, N.A., Purse, B.V., Meiswinkel, R., Brown, H.E., de Koeier, A., Elbers, A.R.W., Boender, G. J., Rogers, D.J., Heesterbeek, J.A.P., 2009.
Mapping the basic reproduction (R0) for vector-borne diseases; a case study on bluetongue virus. Epidem. 1:153-161. - Jubb, K.V.F., Kennedy, P.C., 1970. Bluetongue. In pathology of domestic animals. New York Academic press. 2, 10-14.
- Koeijer de, A.A., Elbers, A.R.W., 2008. Modelling of vector-borne diseases and transmission of bluetongue virus in North-West Europe.
In: Emerging pests and vector-borne diseases in Europe. Wageningen Academic Publishers, Wageningen, pp. 99-112. - Haresnape, J.M., Taylor, W.P., Lungu, S.A.M., 1988. The epidemiology of blueto ngue in Malawi. Epidemiol. Infect. 100, 493-499.
- Hofmann, M.A., Renzullo, S., Mader, M., Chaignat, V., Worwa, G., Thuer, B., 2008. Genetic characterization of Toggenburg orbivirus a new bluetongue virus, from goats, in Switzerland. Em. Infect. Dis. 14, 1855-1861.
- Holwerda M, Santman-Berends IMGA, Harders F, Engelsma M, Vloet RPM, Dijkstra E, et al. Emergence of bluetongue virus serotype 3 in the Netherlands in September 2023. bioRxiv. 2023:2023.09.29.560138.
- Hoogstrall, H., 1979. The epidemiology of tick- born Criemen-Congo Hemorrhagic fever in Asia, Europe and Africa. L. Med. Entamol. 15, 307-417.
- Howell, P.G., Verwoerd, D.W., 1971. Bluetongue virus. In: S. Gard, C. Hallaver and K.F. Meyer, Editors, Virology monographs, Vol 9 springer Verlag, New York, 35-70.
- Hutcheon, D., 1881. Fever of epizootic catarrh. Rept. Coll. Vet. Surg. 12.Laughlin, L.W., Meegan, J.M., Strausbauch, L.J., Morens, D.M., Watten, R.H., 1979.
Epidemic Rift Valley Fever in Egypt : obserbvations of the spectrum of human illness. Tropical Medicine and hygiene, 73, 630-633. - Kramps, J.A., Van Maanen, K., Mars, M.H., Popma, J.K., Van Rijn, P., 2008. Validation of a commercial ELISA for the detection of bluetongue virus (BTV)-specific antibodies in individual milk samples of Dutch dairy cows. Vet. Mic. 130, 80-87.
- Le Gal, M.C., Dufour, B., Geoffroy, E., Zanella, G., Moutou, F., Milleman, Y., Rieffel, J.N., Pouilly, J.N., 2008. Bluetongue virus serotype 8 in the Ardennes in 2007. Vet. Rec. letter 29 November 2008.
- LNV, 2006a. Regulation TRCJZ/2006/2750 regarding bluetongue restriction zones in 2006. http://www.minlnv.nl/portal/page?_pageid=116,1640321&_dad=portal&_schema=PORTAL&p_file_id=16106. Accessed on 17-05-2010.
- Meiswinkel, R., Goffredo, M., Dijkstra, E.G.M., Ven van der, I.J.K., Baldet, T., Elbers, A., 2008. Endophily in Culicoides associated with BTV-infected cattle in the province of Limburg, south-eastern Netherlands, 2006. Prev. Vet. Med. 87, 182-195.
- LNV, 2006b. Bluetongue monitoring and surveillance in the Netherlands. Dutch ministry of agriculture, nature and fisheries, www.minlnv.nl/txmpub/files/?p_file_id=16706 accessed on 22-09-2010.
- MacLachlan, N.J., Osburn, B.I., 1983. Bluetongue virus-induced hydranencephaly in cattle. Vet. Pathol. 20, 563-573.
- Maclachlan, N.J., Conley, A.J., Kennedy, P.C., 2000. Bluetongue and equine viral arteritis viruses as models of virus-induced fetal injury and abortion. Anim. Reprod. Sci. 60-61, 643-651.
- MacLachlan, N.J., 2004. Bluetongue: pathogenesis and duration of viraemia. Vet. Ital. 40, 462-467.
- Marfin, A.A., Petersen, L.R., Eidson, M., Miller, J., Hadler, J., Farello, C., 2001. Widespread West Nile virus activity, Eastern United States, 2000. Emerg. Infect. Dis. 7, 730–735.
- Mars, M.H., Van Maanen, C., Vellema, P., Kramps, J.A., Van Rijn, P. A., 2010. Evaluation of an indirect ELISA for detection of antibodies in bulk milk against bluetongue virus infections in the Netherlands. Vet. Mic. In press.
- Mastroyanni, M., Axiotis, I., Stoforos, E., 1981. Study of the first outbreak of bluetongue disease in sheep in Greece. Bull. Hell. Vet. Ass. 32, 138-144.
- Meiswinkel, R., Baylis, M., Labuschagne, K., 2000. Stabling and the protection of horses from Culicoides bolitinos (Diptera: Ceratopogondiae), a recently identified vector of African horse sickness. Bull. Entomol. Res. 90, 509-515.
- Meiswinkel, R., Paweska, J.T., 2003. Evidence for a new field Culicoides vector of African horse sickness in South Africa. Prev. Vet. Med. 60, 243–253.
- Meiswinkel, R., Gomulski, L.M., Delécolle, J.-C., Goffredo, M., Gasperi, G., 2004. The taxonomy of Culicoides vector complexes-unfinished buiness. Vet. Ital. 40, 151-159.
- Meiswinkel, R., Van Rijn, P., Leijs, P., Goffredo, M., 2007. Potential new Culicoides vector of bluetongue virus in northern Europe. Vet. Rec. 161, 564-565.
- Meiswinkel, R., Baldet, T., De Deken, R., Takken, W., Delécolle, J.-C., Mellor, P.S., 2008a. The 2006 outbreak of bluetongue in nortern Europe- The entomological perspective. Prev. Vet. Med. 87, 55-63.
- Meiswinkel, R., Goffredo, M., Leijs, P., Conte, A., 2008b. The Culicoides ‘snapshot’: A novel approach used to asses vector densities widely and rapidly during the 2006 outbreak of bluetongue (BT) in the Netherlands. Prev. Vet. Med. 87, 98-118.
- Meiswinkel, R., Goffredo, M., Dijkstra, E.G.M., Ven van der, I.J.K., Baldet, T., Elbers, A., 2008c. Endophily in Culicoides associated with BTV-infected cattle in the province of Limburg, south-eastern Netherlands, 2006. Prev. Vet. Med. 87, 182-195.
- Mellor, P.S., Carpenter, S., Harrup, L., Baylis, M., Mertens, P.P.C., 2008. Bluetongue in Europe and the Mediterranean Basin: History of occurrence prior to 2006. Prev. Vet. Med. 87, 4-20.
- Menzies, F.D., McCullough, S.J., McKeown, I.M., Forster, J.L., Jess, S., Batten, C., Murchie, A.K., Gloster, J., Fallows, J.G., Pelgrim, W., Mellor, P.S., Oura, C.A.L., 2008.
Evidence for transplacental and contact transmission of bluetongue virus in cattle. Vet. Rec. 163, 203-209. - Mertens, P.P., Diprose, J., Maan, S., Singh, K.P., Attoui, H., Samuel, A.R., 2004. Bluetongue virus replication, molecular and structural biology. Vet. Ital. 40,426-437.
- Mintiens K., Méroc, E., Faes, C, Cortiñas Abrahantes, J., Hendrickx, G., Staubach, C., Gerbier, G., Elbers, A.R.W., Aerts, M., De Clercq, K., 2008.
Impact of human interventions on the spread of bluetongue virus serotype 8 during the 2006 epidemic in north-western Europe. Prev. Vet. Med. 87, 145–161. - Mullens, B.A., Gerry, A.C., Velten, R.K., 2001. Failure of a permethrin treatment regime to protect against bluetongue virus. J. of Vet. Entomol. 38, 760-762.
- Mo, C.L., Thompson, L.H., Homan, E.J., Oviedo, M.T., Greiner, E.C., González, J., Sáenz, M.R., 1994. Bluetongue virus isolations from vectors and ruminants in Central America and the Caribbean.
Interamerican Bluetongue Team. Am J Vet Res. 55, 211-216. - Moorman, R., 2008. Research programme emerging vector-borne viral diseases at the central veterinary institute. In: proceedings symposium everging vector borne viral diseases on the 28th of November 2008, Lelystad, The Netherlands.
- Muskens, J., Van Wuijckhuise, L., Van Rijn, P., Vellema, P., 2010. Monitoring BTV-8 virus circulation in 2009, in Dutch. Project 2080028, GD Deventer, the Netherlands.
- Nevill, E.M., 1971. Cattle and Culicoides biting midges as possible overwintering hosts of bluetongue virus. Onderstepoort J. of Vet. Res. 38, 65-72.
- Nomikou, K., Mangana-Vougiouka, O., Panagiotatos, D.E., 2004. Overview of bluetongue in Greece. Vet. Ital. 40, 108-115.
- Paweska, J.T., Venter, G.J., Mellor, P.S., 2002. Vector competence of South African Culicoides species for bluetongue virus serotype 1 (BTV-1)
with special reference to the effect of temperature on the rate of virus replication in C. imicola and C. bolitinos (Diptera:Ceratopogonidae). Med. And Vet. Entomol. 16, 10-21. - O’Connell, L., 2002. Entomological aspects of the transmission of arboviral diseases by Culicoides biting midges. PhD, thesis, University of Bristol.
- OIE, 2010a. OIE listed diseases: http://www.oie.int/eng/maladies/en_classification2010.htm?e1d7, accessed on 31-08-2010.
- OIE, 2010b. Disease distribution maps: Bluetongue: http://www.oie.int/wahis/public.php?page=disease_status_map&disease_type=Terrestrial&disease_id=9
&disease_category_terrestrial=0&empty=999999&disease_category_aquatic=0&disease_serotype=0&sta_method=semesterly&selected_start_year=2010&selected_report_period=1&selected_start_month=1&page=disease_status_map&date_submit=OK, accessed on 15-05-2010. - OIE, 2010c. Terrestrial Animal Health code, Chapter 8.3. Bluetongue. www.oie.int/eng/normes/mcode/en_chapitre_1.8.3.pdf,
accessed on 23-09-2010. - Özer, N., 2005. Emerging vector-borne diseases in a changing environment. Turk. J. Biol. 29, 125-135.
- Parsonon, I.M., 1990. Pathology and pathogenesis of bluetongue infections. Curr. Top. Microbiol. Immunol. 162, 119-141.
- Pritchard, L.I., Sendow, I., Lunt, R., Hassan, S.H., Kattenbelt, J., Gould, A.R., Daniels, P.W., Eaton, B.T., 2004. Genetic diversity of bluetongue viruses in South East Asia. Virus Res. 101, 193-201.
- Purse, B.V., Nedelchev, N., Georgiev, G., Velveva, E., Boorman, J., Veronesi, E., Carpenter, S., Baylis, M., Mellor, P.S., 2206. Spatial and temporal distribution of bluetongue and its Culicoides vecors in Bulgaria. Med. Vet. Entomol.. 20, 335-344.
- Tabachnik, W., 2004. Culicoides and the global epidemiology of bluetongue virus infection. Vet. Ital. 40, 145-150.
- Toussaint, J.F., Vandenbussche, F., Mast, J., Demeestere, L., Goris, N., Van Dessel, W., Vanopdenbosch, E., Kerkhofs, P., Zientara, S., Sailleau, C., Czaplicki, G., Depoorter, G., Dochy, J.M., De Clercq, K., 2006. Bluetongue in northern Europe. Vet.Rec. 159, 327.
- Saegerman, C., Mellor, P., Uyttenhoef, J-B. H., Kirschvink, N., Haubruge, E., Delcroix, P., Houtain, J-Y., Pourquier, P., Vandenbussche, F., Verheyden, B., De Clercq, K., Czaplicki, G., 2010. The Most Likely Time and Place of Introduction of BTV8 into Belgian Ruminants. Plos One, http://www.plosone.org/article/info:doi/10.1371/journal.pone.0009405;jsessionid=
3CC91B1C7D02B4C85883721168D3AB75, accessed on 23-05-2010. - Santman-Berends, I.M.G.A., Stegeman, J.A., Vellema, P., Schaik van, G., 2013. Estimation of the reproduction ratio (R(0)) of bluetongue based on serological field data and comparison with other BTV transmission models. Prev. Vet. Med. 108, 276-284.
- Santman-Berends, I.M.G.A., Hage, H., Lam, T.J.G.M., Sampimon, O.C., Schaik van, G., 2010. The effect of bluetongue virus serotype 8 on milk production and somatic cell count in Dutch dairy cows in 2008. J. Dairy Sci. 94, 2476-2484.
- Santman-Berends, I.M.G.A., Schaik van, G., Bartels, C.J.M., Stegeman, J.A., Vellema, P., 2010. Mortality attributable to bluetongue virus serotype 8 infection in Dutch dairy cows. Vet. Mic. 148, 183-188.
- Santman-Berends, I.M.G.A., Hage, J.J., Rijn van, P.A., Stegeman¬, J.A., Schaik van, G., 2010.
BTV-8 in Dutch cows in 2008; fertility performance and the infection status of the offspring. Theriogenology. 74, 1377-1384. - Santman-Berends, I.M.G.A., Bartels, C.J.M., van Schaik, G., Stegeman, J.A., Vellema. P., 2010.
The increase in seroprevalence of bluetongue virus (BTV) serotype 8 infections and associated risk factors in Dutch dairy herds, in 2007. Vet. Mic. 142:268-275. - Santman-Berends, I.M.G.A., van Wuijckhuise, L., Vellema, P., van Rijn, P. A., 2009.
Vertical transmission of bluetongue virus serotype 8 virus in Dutch dairy herds in 2007. Vet. Mic. 141:31-35. - Savini, G., Goffredo, M., Monaco, F., De Santis, P., Meiswinkel, R., 2003. Transmission of bluetongue virus in Italy. Vet. Rec. 152, 119. SCoFCAH, 2007. Presentations European countries December 2006. http://www.knmvd.nl/resources/AMGATE_7364_1_TICH_R34591068822708//, accessed on 17-05-2010.
- Shimshony, A., 2004. Bluetongue in Israel: a brief historical overview. Vet. Ital. 40, 116-118.
- Spreull, J., 1905. Malarial catarrhal fever (bluetongue) of sheep in South Africa. J. Comp. Pathol. Therapy 18, 321-337.
- Sreenivasulu, D., Subba Rao, M.V., Reddy, Y.N., Gard, G.P., 2004. Overview of bluetongue disease, viruses, vectors, surveillance and unique features: the Indian subcontinent and adjacent regions. Vet. Ital. 40, 73-77.
- Stallnecht, D.E., Howerth, E.W., 2004. Epidemiology of bluetongue and epizootic disease in wildlife: surveillance methods. Vet. Ital. 40, 203-207.
- Van den Brink, K. M. J. A., Santman-Berends, I. M. G. A., Harkema, L., Scherpenzeel, C. G. M., Dijkstra, E., Mars, M. H., Holwerda, M., van den Heuvel, N., Spierenburg, M. A. H., van den Brom, R., 2023. Uitbraak van blauwtong serotype 3 in Nederland. Tijdschrift voor diergeneeskunde, 148 issue 7, p38-41. https://www.knmvd.nl/tijdschriften/jaargang-148-aflevering-12- december-2023/.
- van den Brink KMJA, Santman-Berends IMGA, Harkema L, Scherpenzeel CGM, Dijkstra E, Bisschop PIH, Peterson K, van de Burgwal NS, Waldeck HWF, Dijkstra T, Holwerda M, Spierenburg MAH, van den Brom R. Bluetongue virus serotype 3 in ruminants in the Netherlands: Clinical signs, seroprevalence and pathological findings. Vet Rec. 2024 Aug 17;195(4):e4533. doi: 10.1002/vetr.4533. Epub 2024 Aug 15. PMID: 39148262.Van Schaik, G., Berends, I.M.G.A., Van Langen, H., Elbers, A.R.W., Vellema, P., 2008. Seroprevalence of bluetongue serotype 8 in cattle in the Netherlands in spring 2007, and its consequences. Vet. Rec. 163, 441-444.
- Van Schaik, G., Berends, I.M.G.A., Van Langen, H., Elbers, A.R.W., Vellema, P., 2008. Seroprevalence of bluetongue serotype 8 in cattle in the Netherlands in spring 2007, and its consequences. Vet. Rec. 163, 441-444.
- Van Wuijckhuise, L., Dercksen, D., Muskens, J., Bruijn de , J., Scheepers, M., Vrouenraets, R., 2006. Bluetongue in the Netherlands; description of the first clinical cases and differential diagnosis. Common symptoms just a little different and in too many herds. Tijdschr. Diergeneeskd. 131, 649-654.
- Van Wuijckhuise, L., Bartels, C., Wouda, W., Kock, P., 2007. Cattle health surveillance in the Netherlands (2). In proceedings of the Interanational conference of the Canadian Association of Veterinary Epidemiology and Preventive Medicine, 6-15 June 2007, Edmonton Canada.
- Vellema, P., 2008. Bluetongue in sheep: question marks on bluetongue serotype 8 in Europe. Small Ruminant Res. 76, 141-148.
- Venter, G.J., Paweska, J.T., Van Dijk, A.A., Mellor, P.S., Ick, W.J.T., 1998. Vector competence pf Culicoides bolitinos and C. imicola for South African bluetongue virus serotypes 1, 3 and 4. Med. and Vet. Entomol. 12, 378-385.
- Velthuis, A.G.J., Saatkamp, H.W., Mourits, M.C.M., de Koeijer, A.A., Elbers, A.R.W., 2009.
Financial consequences of the Dutch bluetongue serotype 8 epidemics of 2006 and 2007. Prev. Vet. Med. 93, 294-304. - Wäckerlin, R., Eschbaumer, M., König, P., Hoffmann, B., Beer, M., 2010. Evaluation of humoral response and protective efficacy of three inactivated vaccines against bluetongue virus serotype 8 one year after vaccination of sheep and cattle. Vacc. 28, 4348-4355.
- Walton., T.E., 2004. The history of bluetongue and a current global overview. Vet. Ital. 40, 31-31.
- Ward, M.P., Thurmond, M.C., 1995. Climatic factors associated with risk of seroconversion of cattle to bluetongue viruses in Queensland. Prev. Vet. Med. 24, 129-136.
- Williamson S., Woodger, N., Darpel, K., 2008. Differential diagnosis of bluetongue in cattle and sheep. In practice 30, 242-251.
- Wouda, W., Roumen, M.P.H.M., Peperkamp, N.H.M.T., Vos, J.H., Van Garderen, E., Muskens, J., 2008. Hydranencephaly in calves following the bluetongue serotype 8 epidemic in the Netherlands. Vet. Rec. 162:422-423.
- Zhang, N., MacLachlan, N.J., Bonneau, K.R., Zhu, J., Li, Z., Zhang, K., Zhang, F., Xia, L., Xiang, W., 1999. Identification of seven serotypes of bluetongue virus from the people’s Republic of China. Vet. Rec. 145, 427-429.
Bijlage: foto's rund

Laesies op de neusspiegel en in de bek t.g.v. BTV-3

Ernstige verdikte kroonrand t.g.v. BTV-3




Bijlage: Foto's schaap



Oedemateuze longen t.g.v. BTV-3 infectie bij een schaap.

Leasies in de bek van een schaap t.g.v. BTV-3 infectie